学会・セミナー 記録集
講演1|GOZILA studyから学ぶリキッドCGPの活用
演者:中村 能章 先生(国立がん研究センター東病院 国際研究推進室/トランスレーショナルリサーチ支援室/消化管内科)
私からは、我々国立がん研究センター東病院で行ったGOZILA studyから得られた最新の知見と、それを踏まえた実臨床でのリキッドバイオプシー活用のポイントをご紹介いたします。

がんゲノム医療におけるリキッドバイオプシーの有用性
⚫︎SCRUM-Japan GOZILA study:リキッドバイオプシーを用いた大規模ながんゲノムスクリーニングプロジェクト
国立がん研究センター東病院では、2015年にSCRUM-Japan MONSTAR SCREEN1)というプロジェクトを立ち上げました。
がん患者さんに最適な治療を届けることを目的に、全国のがん関連施設と、世界中の製薬企業・バイオテック企業とのコラボレーションを行っています。このMONSTARプロジェクトのもとで様々な研究が行われており、今回ご紹介するGOZILA studyはその一つです。
2018年に始まったGOZILA studyは、全国31施設から約7,000例の消化器がん患者さんを対象に行われました。血液中の血中循環腫瘍DNA(ctDNA)をGuardant360 (本邦薬事未承認製品)で解析し、見つかったゲノム異常に基づき患者さんを臨床試験に登録するというスクリーニングプロジェクトです。
MONSTARプロジェクトのもとで行われている別のプロジェクトGI-SCREENでは腫瘍組織を用いたスクリーニングをしており、このGI-SCREENとGOZILA studyを比較した論文が2020年にNature Medicineに掲載されました2)。
つまり組織検体検査とリキッドバイオプシーのctDNA検査の比較をしたわけです。
治療標的となる遺伝子異常の同定割合は組織 54%、ctDNA検査 57%と同程度でしたが、特筆すべきはGuardant360のスピード感で、登録から検査結果報告までの期間の中央値が組織検査 33日、ctDNA検査 11日(p<0.0001、Mann-Whitney検定、両側)と、外来であれば次の来院日にはもう結果が分かっている状態でした。
このスピード感が、臨床試験に登録された患者割合の差につながったように思われます(組織検査 4.1%、ctDNA 9.5%)。登録された臨床試験での治療効果(奏効率や無増悪生存期間[PFS])の比較結果も論文内で紹介していますが組織検査とctDNA検査で同等で、進行消化器がんでのリキッドCGPの有用性を示す結果と考えます。
昨年2024年に、GOZILA studyのアップデートデータが、同じくNature Medicineに掲載されました。
2018年1月から2022年8月までの4,037例を対象に全生存期間(OS)を解析しています(図1)。
その結果、リキッドCGPの結果に基づき適合する治療を受けた患者さん(902例:Matched群)は、適合する治療を受けなかった患者さん(2,377例:Unmatched群)よりもOS中央値が約2倍長い3)ことが明らかになりました(OS中央値 18.6ヵ月 vs 9.9ヵ月、HR 0.54 [95%CI 0.49-0.59]、log-rank検定)。
なお、治療につながるバイオマーカーが見つからなかった患者さん(574例:No actionable群)のOS中央値は16.8ヵ月と、Matched群ほどではないですがUnmatched群に比べるとかなり良いOSでした。
医療現場では、検査をして遺伝子異常の報告がないと少し残念な気持ちになりがちかもしれませんが、遺伝子異常というのは “悪さ” をして、時に治療抵抗性にも結び付きます。
そういった悪さをするものがない状態であることがこのOSに反映されていると思われます。
また、腫瘍があまりアグレッシブではない時にはctDNA量も少なく、検出されにくい傾向にありますので、腫瘍が ”今はおとなしい状態” の患者さんも含まれているのではないかと思います。
遺伝子異常が何も出なかったとしても、決して残念に思うことはない、とこの結果からは解釈できると考えます。
![リキッドバイオプシーに基づくがん個別化医療による全生存期間[GOZILA study]](/cms/wp-content/themes/betheme/images/seminar/01/img1.png)
⚫︎TRIUMPH試験:HER2陽性大腸がんを対象とした第Ⅱ相医師主導治験
また、GOZILA studyのプラットフォームでは様々なアンブレラ/バスケット型の医師主導治験が実施されており、そのひとつにTRIUMPH試験4)があります。HER2陽性*という非常に希少な異常を有する切除不能・進行再発大腸がん患者さんを対象に、抗HER2抗体ペルツズマブ+トラスツズマブ併用療法を行った結果、有効性が確認され、このTRIUMPH試験の結果をもとに薬事承認が得られました。
HER2陽性大腸がんに対する世界初の承認薬として、承認から1年で日本全国約140名の患者さんがペルツズマブ+トラスツズマブで治療されたと聞いています。
*:
組織検査でHER2陽性(IHC 3+ or FISH positive [HER2/CEP17 ratio≧2.0])またはctDNAでERBB2増幅+RAS野生型
他にも、ctDNAでHER2増幅が認められた固形がんの患者さんに対しトラスツズマブ デルクステカンを投与するHERALD試験5)なども行っており、今後は臓器横断的に、Guardant360のctDNA解析で遺伝子異常が見つかった患者さんに治療が届けられる可能性があります。
2種類のがん不均一性をリキッドCGPで捉える
⚫︎空間的不均一性と時間的不均一性
がんというものは非常に不均一です。原発巣と転移巣の間で違う「空間的不均一性」、また病態進行に伴う「時間的不均一性」があります。これら2種類の不均一性を見るのは組織生検では困難ですが、リキッドCGPであれば捉えることができます。
- ・時間的不均一性:抗EGFR抗体薬リチャレンジの可能性
-
大腸がんで話題にのぼるのが、抗EGFR抗体薬のリチャレンジです。
RAS野生型の切除不能・進行再発大腸がんの患者さんに抗EGFR抗体薬で治療を行うと、RAS変異を持った細胞が増え治療抵抗性が出てくることがありますが、抗EGFR抗体薬以外の治療に切り替えると、このRAS変異型の細胞が減少し、再度RAS野生型の細胞が優位になることがあります。
そのタイミングでリキッドCGPを行いRAS野生型と判定されれば、抗EGFR抗体薬のリチャレンジができるのではないか、というものです。
実際に抗EGFR抗体薬のリチャレンジを評価したイタリアのCHRONOS trial6)では、リチャレンジでの奏効率が30%と報告されています。 - ・空間的不均一性:原発巣と転移巣でゲノムが異なる症例もリキッドバイオプシーで評価可能
-
原発巣と転移巣でゲノムが異なっていることがリキッドCGPで分かり、有効な治療選択につながった症例を経験しています。
肝肺転移を伴うRAS/BRAF野生型の大腸がん患者さんでした。
FOLFOX+セツキシマブから始めた一連の標準治療が終了するタイミングでGOZILA studyに参加、Guardant360でctDNA解析を行ったところ、最初の組織検査では出ていなかったBRAF V600E変異が報告されました(図2)。
この検査結果を受け、エンコラフェニブ+ビニメチニブ+セツキシマブに治療を切り替えました7)。

この他にも、以下のような症例が報告されています。
- ・十二指腸がんALK-fusion → ALK L1196M(ブリグチニブで治療)8,9)
- ・原発不明がんMSI-Hが組織では陰性、ctDNAでは陽性(ペムブロリズマブで治療)10)
- ・胃がんFGFR2陰性→ FGFR2増幅(FGFR阻害薬で治療)11)
以上のように、がんの時間的・空間的不均一性を踏まえると、ctDNA解析でこそ見つけられるケースがあるということはご理解いただけるかと思います。有効な治療につながっていくこともありますので、治療に難渋している場合にはリキッドCGPを検討してみるのも選択肢のひとつかと思います。
がん克服を目指したリキッドバイオプシーによるがん個別化治療の試み
本日は進行がんにおけるリキッドCGPについてご説明しました。
進行がんに対しリキッドCGPを活用することで、生存期間の延長につながることが期待できます。
今後の展望としては、再発予防を目指した局所進行がんでの活用、早期発見・早期治療を目指した早期がんでの活用を視野に、がん克服を目指していきたいと考えています(図3)。

- 1) Hashimoto T, Nakamura Y, et al. Cancer Discov 2024;14(11):2243-2261. [PMID: 39023403]
- 2) Nakamura Y, et al. Nat Med 2025;31(1):165-175. [PMID: 39284955]
- 3) 国立がん研究センター プレスリリース 2024年9月17日発表
https://www.ncc.go.jp/jp/information/pr_release/2024/0917_2/index.html(2025年4月1日閲覧) - 4) Nakamura Y, et al. Nat Med 2021;27(11):1899-1903. [PMID: 34764486]
- 5) Yagisawa M, et al. J Clin Oncol 2024;42(32):3817-3825. [PMID: 39088783]
- 6) Sartore-Bianchi A, et al. Nat Med 2022;28(8):1612-1618. [PMID: 35915157]
- 7) Kotani D, Nakamura Y, et al. Lancet Oncol 2022;23(4):463-464. [PMID: 35358454]
- 8) Isaka Y, Nakamura Y, et al. Front Oncol 2023;12:1064944. [PMID: 36713517]
- 9) Sasaki A, Nakamura Y, et al. Int Cancer Conf J 2025;14(2):131-135. [PMID: 40160872]
- 10)Nakamura Y, et al. JSCO 2021; Abst# O24-4
- 11)Jogo T, Nakamura Y, et al. Clin Cancer Res 2021;27(20):5619-5627. [PMID: 34376535]
| 中村能章先生監修 | ガーダントヘルスジャパン資材『Guardant360® CDxがん遺伝子パネルにおけるLiquid Biopsy実践ガイド』より
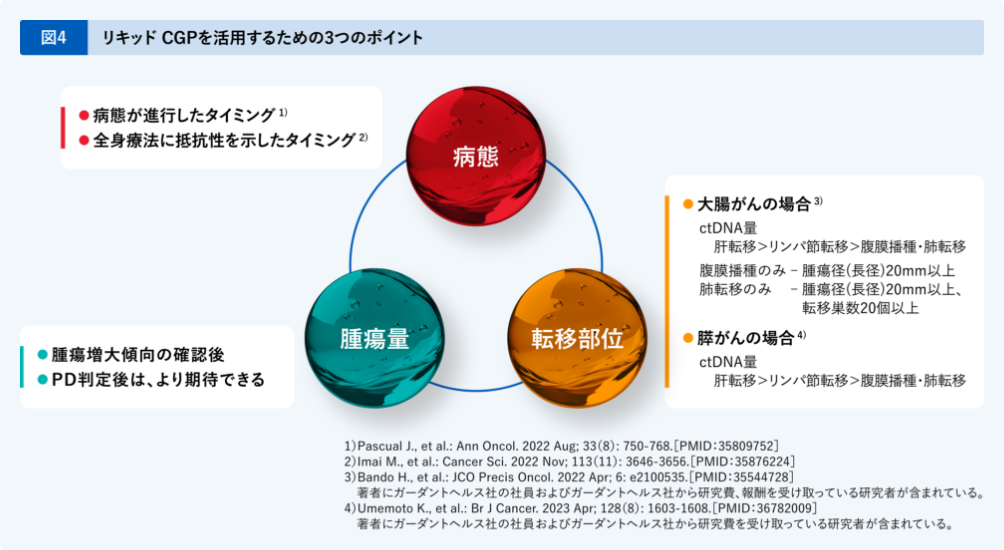
リキッドCGPを活用するための3つのポイント
リキッドCGPを活用するには、3つポイントがあります(図4)。
- 1病態
- ESMO Precision Medicine Working Groupのrecommendationでは、「病態が進行したタイミング」での実施が、また、国内Expert panel commitieeのrecommendationでは、「全身療法に抵抗性を示したタイミング」での実施が推奨されています。
- 2腫瘍量
- 腫瘍量がなるべく多い状態、例えば腫瘍の増大傾向を確認した後や、PD判定後の採血で、検出がより期待できます。
- 3転移部位
- 転移部位によっても、ctDNA量は違うと報告されています。大腸がんの場合、肝転移、リンパ節転移、腹膜播種と肺転移の順にctDNA量が多いと報告されています。ただ、腹膜播種のみの場合でも、腫瘍の長径が20mm以上、肺転移のみの場合でも腫瘍の長径が20mm以上もしくは転移巣数20個以上であればctDNA量は多い傾向にあり、検出が期待できます。膵がんでも同様に、肝転移、リンパ節転移、腹膜播種と肺転移の順にctDNA量が多いと報告されています。
リキッドCGPを活用するためには、このような「病態」、「腫瘍量」、「転移部位」などを総合的に考え、
採血のタイミングを判断していくことが肝要です。
※
ガーダントヘルスジャパン注)
資材『Guardant360® CDx がん遺伝子パネルにおけるLiquid Biopsy 実践ガイド』は、パンフレットおよび
動画でもご覧いただけます。ご希望の方は、ガーダントヘルスジャパンの担当者までご連絡ください。

